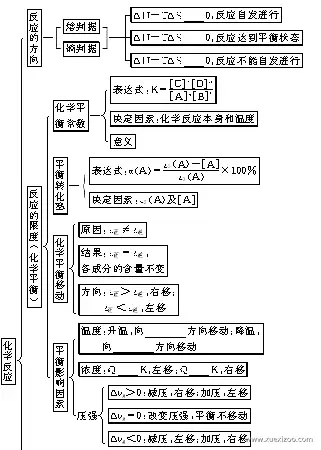
化学反应的方向与限度
化学反应的方向与限度
化学反应的方向与限度是化学反应中重要的概念,它们决定了反应的产物和反应的程度。
化学反应的方向
化学反应的方向是指反应物转化为产物的过程。化学反应的方向与反应物的能量有关,反应物能量较高,反应倾向于生成能量较低的产物;反应物能量较低,反应倾向于生成能量较高的产物。
化学反应的限度
化学反应的限度是指反应物完全转化为产物时所达到的产物浓度或产物数量。反应的限度取决于反应物浓度、反应温度、反应时间、催化剂和其他因素。
影响化学反应方向与限度的因素
-
反应物的能量:反应物能量较高,反应倾向于生成能量较低的产物;反应物能量较低,反应倾向于生成能量较高的产物。
-
反应物的浓度:反应物浓度越高,反应速度越快,反应的限度也越大。
-
反应温度:反应温度越高,反应速度越快,反应的限度也越大。
-
反应时间:反应时间越长,反应速度越大,反应的限度也越大。
-
催化剂:催化剂可以降低反应的活化能,使反应速度加快,反应的限度也越大。
-
其他因素:如反应物的性质、反应物的状态、反应物的粒度、反应物的纯度等因素也会影响化学反应的方向与限度。
化学反应方向与限度的应用
化学反应的方向与限度在化学工业、制药工业和农业等领域都有着广泛的应用。例如,在化学工业中,通过控制反应物的浓度、温度、时间和催化剂等因素,可以控制反应的方向和限度,从而实现特定产品的生产。在制药工业中,通过控制反应物的浓度、温度、时间和催化剂等因素,可以控制反应的方向和限度,从而实现特定药物的合成。在农业中,通过控制反应物的浓度、温度、时间和催化剂等因素,可以控制反应的方向和限度,从而实现特定农产品的生产。
化学反应方向与限度的研究
化学反应方向与限度是化学研究中的一个重要领域。通过对化学反应方向与限度的研究,可以揭示化学反应的机理,预测反应的产物和产物的数量,并控制反应的方向和限度,从而实现特定产品的生产。
作者:小龙人
链接:https://www.xuexizoo.com/article/1759808063168069895.html
文章版权归作者所有,未经允许请勿转载。如有侵权,请发邮件联系管理员进行处理,邮箱地址:121671486@qq.com




赶快来坐沙发