催化剂为什么能加快反应速度
催化剂之所以能够加快反应速度,主要有以下几个原因:
-
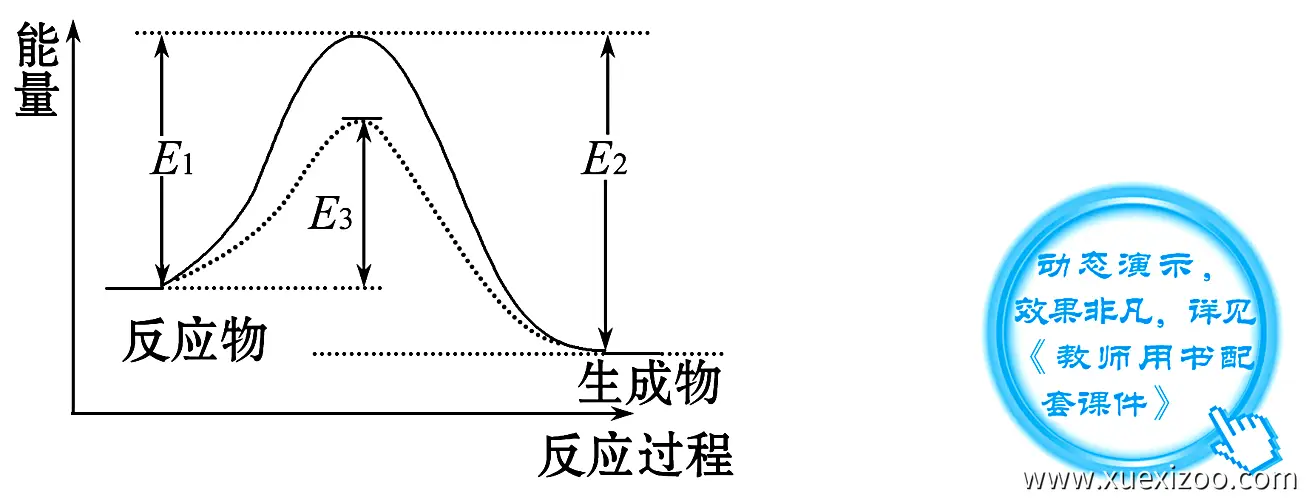
降低反应活化能:催化剂的存在降低了反应所需的活化能,使反应更容易发生。活化能是反应物分子转化为产物分子所需的能量。催化剂通过提供一种新的反应途径或降低反应物分子的能量,从而减少了活化能。
-
增加反应物有效碰撞次数:催化剂的存在增加了反应物有效碰撞的次数,从而提高了反应速度。催化剂常常通过提供一种新的反应途径或改变反应物分子间的相互作用,使反应物分子更容易发生有效碰撞。
-
改变反应途径:催化剂的存在可以改变反应的途径,使反应更容易进行。例如,某些催化剂可以帮助反应物分子以不同的方式结合,或者通过提供一种新的反应路径,使反应更容易发生。
-
提供反应中间体:催化剂可以通过形成反应中间体,降低反应的活化能,从而加快反应速度。反应中间体是一种不稳定的分子,由反应物分子和催化剂分子结合而成。反应中间体更容易转化为产物分子,因此可以降低反应的活化能。
-
改变反应环境:有些催化剂可以通过改变反应环境,例如温度、压力、pH值等,来加速反应。这些催化剂可以使反应物分子更加活跃,从而加快反应速度。
版权声明:
作者:小龙人
链接:https://www.xuexizoo.com/article/1759808063168069895.html
文章版权归作者所有,未经允许请勿转载。如有侵权,请发邮件联系管理员进行处理,邮箱地址:121671486@qq.com
作者:小龙人
链接:https://www.xuexizoo.com/article/1759808063168069895.html
文章版权归作者所有,未经允许请勿转载。如有侵权,请发邮件联系管理员进行处理,邮箱地址:121671486@qq.com
THE END
0
分享
二维码
海报
发表评论




赶快来坐沙发