金属的电极电位是什么意思
金属的电极电位是什么意思?
金属的电极电位是指金属在电化学反应中失去电子成为阳离子的趋势。它是由金属的还原电势决定的,还原电势越大,金属的电极电位越正,越容易失去电子。
金属的电极电位与金属的活性有关,活性越强的金属,电极电位越负,越容易发生氧化反应。例如,钠的电极电位为-2.71V,而铜的电极电位为+0.34V。这意味着钠比铜更容易失去电子,因此钠比铜更活泼。
金属的电极电位还与金属的氧化态有关。金属的氧化态越高,电极电位越正,越容易失去电子。例如,铁的电极电位在+2氧化态为-0.44V,而在+3氧化态为+0.56V。这意味着铁在+3氧化态比在+2氧化态更容易失去电子。
金属的电极电位在电化学反应中起着重要作用。它决定了金属在电化学反应中的氧化还原方向。例如,如果金属的电极电位比氢的电极电位更负,则金属可以被氢还原。反之,如果金属的电极电位比氢的电极电位更正,则金属可以将氢氧化。
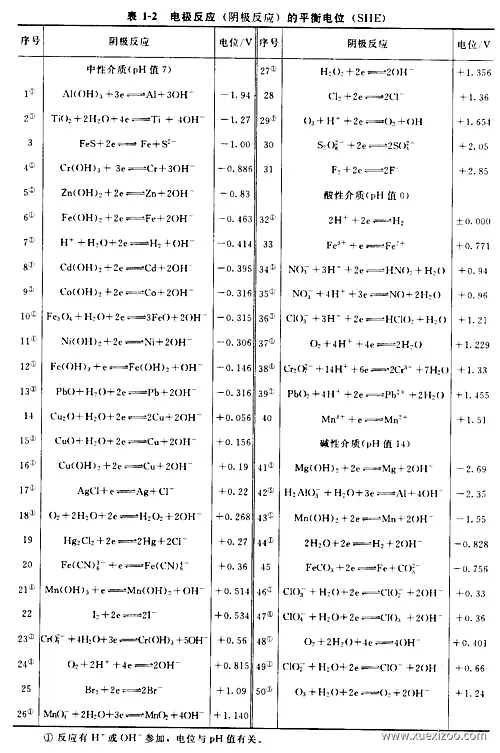
金属的电极电位在电化学领域有着广泛的应用。它可以用来预测电化学反应的方向,计算电化学反应的平衡常数,设计电化学电池和电解池,以及研究金属的腐蚀行为。
阅读剩余
版权声明:
作者:小龙人
链接:https://www.xuexizoo.com/article/1759808063168069895.html
文章版权归作者所有,未经允许请勿转载。如有侵权,请发邮件联系管理员进行处理,邮箱地址:121671486@qq.com
作者:小龙人
链接:https://www.xuexizoo.com/article/1759808063168069895.html
文章版权归作者所有,未经允许请勿转载。如有侵权,请发邮件联系管理员进行处理,邮箱地址:121671486@qq.com
THE END